2025年6月6日,海洋生命学院方宗熙海洋生物进化与发育研究中心董波教授团队在国际权威期刊PNAS(美国科学院院刊)上以长篇论文形式在线发表研究成果“Physics of notochord tube expansion in ascidians”(海鞘脊索管腔膨胀的物理学模型)。该论文利用进化关键节点动物海鞘脊索管腔形态发生作为研究对象,发现Cdc42信号调节的细胞皮质收缩环产生的机械收缩力和细胞间紧密连接的物理阻隔作用是细胞对腔液的几何形态与体积调控的关键机制。基于实验证据和守恒原理,该研究首次建立了细胞-腔液相互作用下的通用管腔膨胀模型。通过估算关键管腔膨胀参数取值,结合实验方法和数值模拟,作者成功预测了在多种条件下的管腔生长动力学,并进一步验证肌动球蛋白收缩驱动的主动力学过程与水动力过程之间的耦合关系。
管腔结构(tubular structure)广泛存在于多种器官系统中并发挥重要的生理功能,包括气体、液体、生物大分子和细胞的储存与运输等。管腔能够作为生化信号中心引导组织模式的建立,或通过机械转导调控细胞命运与行为。相反,管腔形成出现异常则会产生疾病,例如多囊肾病与淋巴管狭窄等。因此,对于管腔形成的细胞学过程的深入理解,阐明管腔膨胀的分子和力学调控机制,对于理解管腔的生物学功能和相关疾病的发生机理具有重要科学意义。管腔的生长、成熟和稳定涉及诸多细胞过程,包括细胞骨架动态重塑、膜泡运输以及渗透压梯度建立等,其对于管腔的形态和体积调节和发挥正确生物学功能是必不可少的。然而,细胞如何精确调控细胞骨架并产生机械力,从而塑造出有功能的管状器官?另外,参与管腔生长和成熟的多种细胞过程分别调节管腔器官的哪些具体的几何参数和生物学功能,这些复杂的细胞过程又是如何协调统一,形成一个完整的功能网络的?目前,对于这些基本的发育生物学问题都还没有明确的答案。
海鞘脊索管腔系统作为一种新兴的模式管腔系统,由于其发育过程十分简单,便于使用显微镜观察,因此正在得到更多的研究和关注。脊索管腔最初在两个脊索细胞的中间形成并膨胀,随后通过细胞迁移将分离的腔液连接在一起形成一个贯穿脊索的多细胞管腔(图1A-B)。该研究首先构建了脊索特异表达的细胞皮质荧光标记转基因玻璃海鞘(Lifeact-eGFP) ,对管腔膨胀过程的几何参数进行了精确统计,随后通过统计不同发育时期的脊索皮质荧光信号分布,发现管腔边缘存在特殊的肌动球蛋白皮质收缩环结构,且收缩环强度和管腔的几何形状存在明显的相关性。为了寻找细胞对皮质信号的上游调控机制,该研究系统地筛选了在脊索高表达的Rho GTPases家族蛋白,随后发现Cdc42的显性负性突变会造成脊索发育和管腔形成的严重畸形。随后他们关注于细胞对管腔体积的调控机制,通过过表达紧密连接蛋白ZO1的结构域缺失突变体,发现其会造成管腔体积的明显减小。
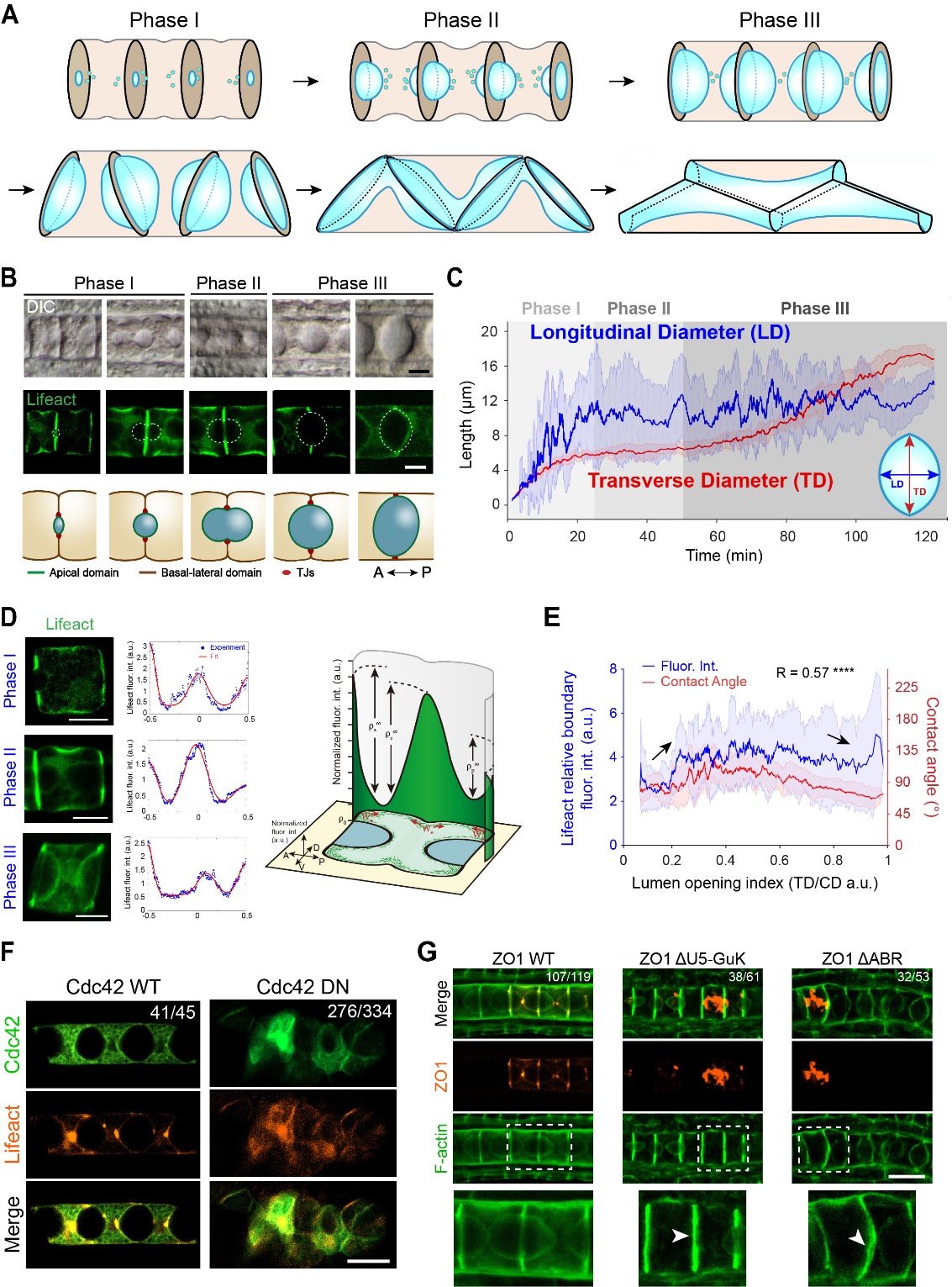
图1:(A) 海鞘脊索管腔的发育过程。(B) 差分干涉显微镜图像、Lifeact标记细胞皮质信号的共聚焦显微镜图像和模式图显示管腔形成各阶段的典型形态和尺寸。(C) 管腔横向直径(TD)与纵向直径(LD)的定量统计数据。(D) 脊索组织皮质分布在管腔形成各阶段的典型分布特征。(E) 管腔边缘的皮质信号强度和管腔的几何形状间存在强相关性。(F) Cdc42的显性负性突变可造成脊索管腔形成的严重畸形)。(G) 紧密连接蛋白ZO1的结构域功能缺失可造成管腔体积的显著减小。
基于该研究所发现的细胞对于管腔的调控机制和该实验室前期对于管腔形成机制的系统研究,利用守恒原理,建立了细胞-腔液协同作用下的通用管腔膨胀物理模型。在该模型中,对于主动力学过程,作者考虑了静水压和膜张力的平衡,以及肌动球蛋白收缩环的动态调控。在渗透压的建立机制建模中,作者构建了离子守恒方程和体积守恒方程,考虑了紧密连接的稳定性、离子/水的主动运输、被动不可逆热力学扩散和膜泡运输等过程。
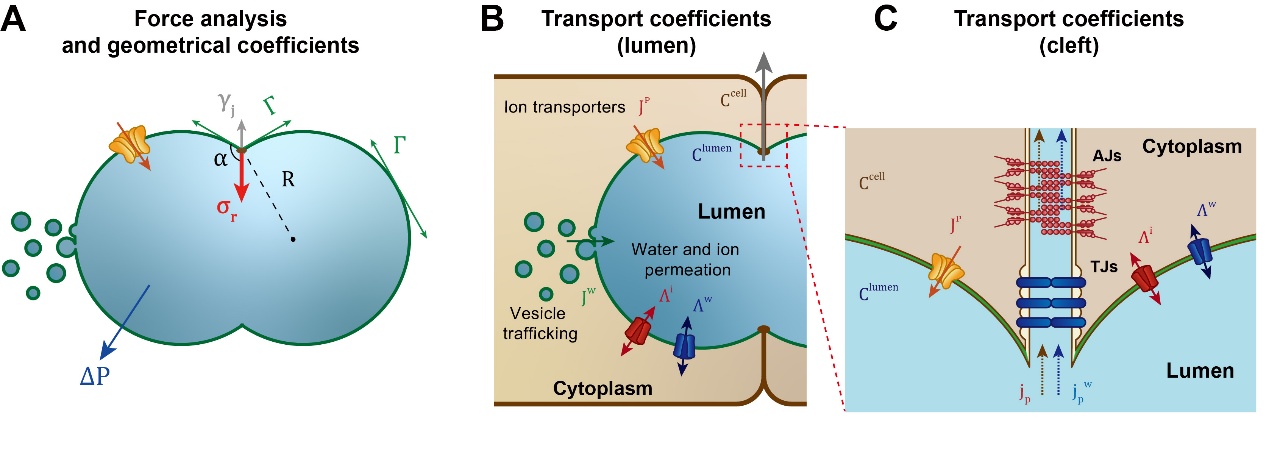
图2:(A) 管腔形成的受力分析和几何参数的定义。(B) 管腔膜上的离子和水的主动运输和被动扩散机制。(C) 细胞-细胞间隙的离子和水的泄漏机制。
随后,该研究对所建立的模型进行了数值求解。利用实验观测得到的管腔几何数据和收缩环强度变化数据,作者模拟了野生型管腔膨胀的动力学过程,得到了生理状态下的模型参数的合理取值区间,并反推了各机械力的时间变化规律。在此基础上,该研究成功预测并解释了管腔形成过程受到干扰后的动力学表型的成因。例如,在离子泵蛋白SLC26aα过表达后,通过增加离子泵的模型参数取值,同时修正细胞-细胞连接处的张力以满足张力的边界条件,数值模拟可以十分成功地复现实验观测结果。作者进一步预测了不同情况下的干扰后管腔动力学表型,从而总结了细胞对管腔的复杂细胞学调控网络的具体调控机制,并给出了生物学过程的理论阈值。
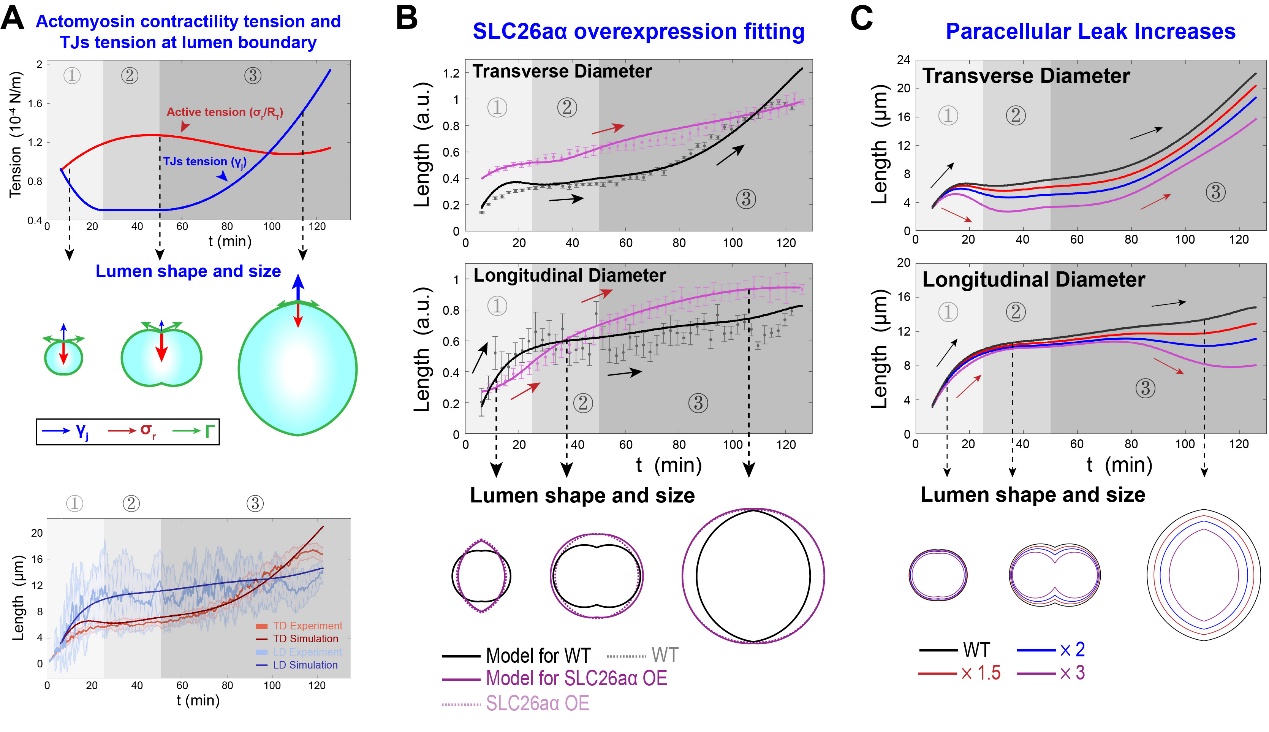
图3:(A) 海鞘脊索管腔膨胀过程的数值模拟。(B) 模型求解解释离子泵运输过程受到干扰后的管腔动力学表型的成因。其中,实线表示模型预测的管腔膨胀过程,散点表示干扰后的实验观测数据。(C) 模型预测边缘泄漏增加后的管腔膨胀动力学过程。
综上所述,该研究明确了管腔膨胀与稳态维持的关键细胞调控机制,为系统阐明生物管腔的生物学调控网络奠定了重要基础。有趣的是,人类肝脏中的胆小管(bile canaliculi)具有和海鞘脊索管腔十分相似的结构,该研究所建立的管腔膨胀的动力学模型可为胆小管相关疾病的致病机理的鉴定和治疗提供理论依据。
在此项研究发表之前,董波教授团队已经开展了海鞘脊索管腔的生物学调控机制开展研究。他们通过脊索组织的单细胞分离和蛋白组学鉴定,揭示了囊泡运输和膜补充对于管腔膨胀的必要性(1),同时发现小窝蛋白介导的膜融合参与了管腔膨胀过程(2)。该研究团队进一步发现,ADP-核糖基化因子GTP酶激活蛋白家族成员ELMOD3可与Rab1A和Flotillin2相互作用,并调控Flotillin2介导的从细胞质至顶膜的囊泡运输过程(3)。此外,DRYK1调控的内吞作用对腔体扩张同样是必需的(4)。这些研究系统阐述了囊泡运输循环对于管腔形成的必要性,有助于更全面理解管状结构扩张的普遍机制。
方宗熙中心博士生施文杰、法国居里研究所Charlie Duclut副教授、生命学院许艳教授为本论文共同第一作者,团队负责人董波教授、法国居里研究所Charlie Duclut副教授为通讯作者。法国居里研究所Jacques Prost院士对本项目给予了持续关注和支持。研究工作得到了青岛海洋科技中心科技创新项目、国家重点研发项目和山东省泰山学者计划等项目资助。学校大生命高性能超算中心提供了必要资源和技术支持。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2419960122
参考文献
1.Wang Z, et al. (2023) Proteomic identification of intracellular vesicle trafficking and protein glycosylation requirements for lumen inflation in Ciona notochord. Proteomics 23(10):e2200460.
2. Bhattachan P, et al. (2020) Ascidian caveolin induces membrane curvature and protects tissue integrity and morphology during embryogenesis. FASEB J. 34(1):1345-1361.
3.Liu A, Ouyang X, Wang Z, & Dong B (2023) ELMOD3-Rab1A-Flotillin2 cascade regulates lumen formation via vesicle trafficking in Ciona notochord. Open Biol. 13(3):220367.
4.Ouyang X, Wu B, Yu H, & Dong B (2023) DYRK1-mediated phosphorylation of endocytic components is required for extracellular lumen expansion in ascidian notochord. Biol. Res. 56(1):10.

